En un paciente VIH sin tratamiento retroviral, con elevada carga viral y CD4 < 250 que presenta disfunción neurológica con o sin focalidad hay que pensar en varias entidades en el diagnóstico diferencial.
Exploraciones complementarias a realizar:
- Análisis de sangre completo: electrolitos, glucosa, función hepática y renal, lactato.
- Gasometría venosa (CO₂ elevado puede producir coma reversible: hipercapnia).
- Carga viral, subpoblaciones linfocitarias, niveles de CD4.
- TC craneal en vacío y con contraste intravenoso.
- Tóxicos en orina.
- Punción lumbar, debiendo valorar la presión de apertura y solicitar:
» Aspecto macroscópico.
» Citobioquímica con proteínas, glucosa, recuento celular con formula leucocitaria.
» Tinta china y antígeno criptocócico (altísima sensibilidad).
» Gram.
» Cultivo bacteriano
» Cultivo para hongos
» Ziehl-Neelsen + cultivo para micobacterias (si sospecha de TB)
» PCR para VHS-1 y VHS-2, VZV, EBV, enterovirus, JC virus (si sospecha de LMP; aunque suele requerir RM)
» Carga viral del VIH en LCR (si dudas de encefalopatía por VIH)
» Citología LCR (linfoma primario SNC si RM/síntomas orientan)
- RMN cerebral.
- Electroencefalograma (EEG).
ENCEFALOPATÍA METABÓLICA O TÓXICA
El inicio brusco del cuadro, y la rápida reversibilidad con un TAC cerebral normal hacen probable que se trate de un origen metabólico o toxico, por lo que debe descartarse entre las distintas causas:
- Hiponatremia / alteraciones electrolíticas severas
- Insuficiencia hepática o encefalopatía hepática
- Insuficiencia renal / uremia
- Hipoglucemia o hiperglucemia severa
- Sobredosis o efectos de sustancias / fármacos
- Sepsis con disfunción neurológica transitoria (encefalopatía séptica)
Estas causas pueden producir alteraciones del nivel de conciencia, incluso coma, sin lesiones evidentes en el TC y mejorar rápidamente con la corrección de la causa.
MENINGITIS CRIPTOCOCICA
Esta entidad es muy frecuente en pacientes VIH con CD4 < 250, por lo que todo paciente VIH si lesiones ni edema en el TC cerebral debe de realizarse una punción lumbar. Esta entidad suele debutar con signos meníngeos o cefalea, y en ocasiones debuta con alteración del nivel de conciencia a veces fluctuante, incluso coma, y el TC puede ser normal.
| 1 – FISIOPATOLOGIA |
La produce Cryptococcus neoformans (más común en VIH) o C. gattii. El mecanismo fisiopatológico se inicia en un primer paso con la inhalación del hongo con primoinfección pulmonar, que en individuos inmunocompetentes suele quedar controlado. Posteriormente se producirá la diseminación hematógena en inmunodeprimidos con CD4 < 100 – 200, pues el sistema inmune no puede controlar la replicación y el hongo pasa a la sangre. A partir de la fungemía se producirá la invasión del SNC atravesando la barrera hematoencefálica con la entrada de macrófagos infectados o bien por la migración directa transcelular o paracelular. Una vez en el LCR se producirá su proliferación por alta replicación aumentando la presión intracraneal (PIC), que clínicamente es lo más importantes consecuencia de la obstrucción de las granulaciones de Pacchioni lo que disminuirá la reabsorción de LCR lo que genera una hipertensión intracraneal mantenida (HIC) responsable de la clínica de cefalea, visión borrosa, alteración del nivel de conciencia e incluso coma. En este sentido la HIC es la principal causa de deterioro neurológico y de fallecimiento.
2 – DIAGNOSTICO
En el diagnóstico es clave:
● PUNCIÓN LUMBAR Y ANALISIS DEL LCR (prueba clave)
» Citobioquímica del LCR:
- Presión de apertura elevada (> 25 cmH₂O, a veces >40)
- Aspecto claro
- Pocas células (10–100, linfocitos predominantes)
- Proteínas moderadamente elevadas
- Glucosa baja o normal
» Pruebas específicas:
- Antígeno criptocócico (CrAg) en LCR. Dispone de una sensibilidad > 95 %, lo que traduce que su positividad es diagnóstica.
- Tinta china (India ink), visualiza la cápsula. Es menos sensible, pero rápida.
- Cultivo de LCR, permite confirmar la especie, es más lento.
● Antígeno criptocócico sérico → muy sensible en VIH. Ayuda si no es posible la PL de inmediato.
● Neuroimagen
» TAC cerebral. En la interpretación del TAC se debe tener las siguientes consideraciones:
– Un TC sin contraste intravenoso puede ser normal, porque el criptococo no suele producir edema masivo, no genera colecciones purulentas densas y no altera densidades del parénquima en fases iniciales. Por tanto, el TC cerebral es normal en un porcentaje elevado de pacientes, por eso no descarta meningitis criptocócica ni ninguna meningoencefalitis del VIH.
– Un TC cerebral con contraste, aunque menos sensible que la RMN, puede mostrar:
1. Realce meníngeo leve, sobre todo basal, aunque no siempre está presente en criptococo.
2. Granulomas o pseudquistes gelatinosos que son pequeñas lesiones quísticas en ganglios basales o sustancia blanca, siendo mejor visibles con RM con gadolinio.
3. Hidrocefalia, en forma de dilatación ventricular por obstrucción de reabsorción de LCR.
4. Lesiones nodulares (menos frecuente)
● La RMN cerebral puede mostrar pseudoquistes gelatinosos, lesiones nodulares dilatación ventricular.
| Imagen de RMN con imágenes axiales FLAIR (A) y DWI (B) donde se evidencia un criptococoma parenquimatoso a nivel de los ganglios de la base en un paciente VIH. |
3 – TRATAMIENTO
El tratamiento tiene tres pilares: por un lado el tratamiento antifúngico, el control de la presión intracraneal y tratamiento retroviral de alta eficacia una vez controlado el proceso infeccioso.
1) Tratamiento antifúngico (3 fases)
a) Inducción(las primeras 2 semanas) cuyo objetivo: esterilizar el LCR rápidamente.
El esquema preferido (OMS/IDSA): Anfotericina B liposomal 3–4 mg/kg/día + Flucitosina 100 mg/kg/día en 4 dosis. Si no hay flucitosina: Anfotericina B + fluconazol 800–1200 mg/d.
b) Consolidación (8 semanas):Fluconazol 400–800 mg/día
c) Mantenimiento (≥ 1 año o hasta recuperación inmunológica):Fluconazol 200 mg/día
2) Control de la presión intracraneal (CRUCIAL). La mortalidad se relaciona más con la HIC que con el hongo. Las medidas a considerar son:
- Punción lumbar evacuadora diaria para mantener presión < 20–25 cmH₂O y si persiste HIC: drenaje lumbar o derivación ventrículo-peritoneal (una vez estabilizado).
- Evitar manitol y corticoides → No son eficaces salvo indicación específica.
3) Tratamiento antirretroviral (TAR) (esperar entre 4 y 6 semanas después de empezar el tratamiento)
No se recomienda iniciar precozmente el tratamiento antirretroviral (TAR) en la meningitis criptocócica porque incrementa de forma significativa el riesgo del Síndrome de Respuesta Inflamatoria Inmune (SIRI), que es un síndrome inflamatorio que puede ser grave o mortal en esta enfermedad.
Cuando se inicia el TAR, el sistema inmune comienza a recuperarse subiendo los CD4, disminuye la carga viral y aumenta la capacidad de respuesta inflamatoria. De manera que un paciente con Cryptococcus aún presente en el SNC (aunque ya esté en tratamiento antifúngico), esta recuperación inmunitaria puede provocar una reacción inflamatoria exagerada contra el hongo con aumento brusco de la presión intracraneal, edema cerebral, deterioro neurológico agudo y fallecimiento.
Los estudios clínicos muestran que iniciar TAR demasiado pronto (< 2 semanas) aumenta la mortalidad en meningitis criptocócica y duplica o triplica el riesgo de SIRI grave. Por eso todas las guías (OMS, CDC, IDSA, EACS) recomiendan no iniciar TAR de forma inmediata.
La recomendación actual es iniciar TAR entre 4 y 6 semanas después de comenzar el tratamiento antifúngico. Este intervalo permite reducir carga fúngica, disminuir la presión intracraneal, disminuir antígenos criptocócicos en LCR y disminuir significativamente el riesgo de SIRI grave.
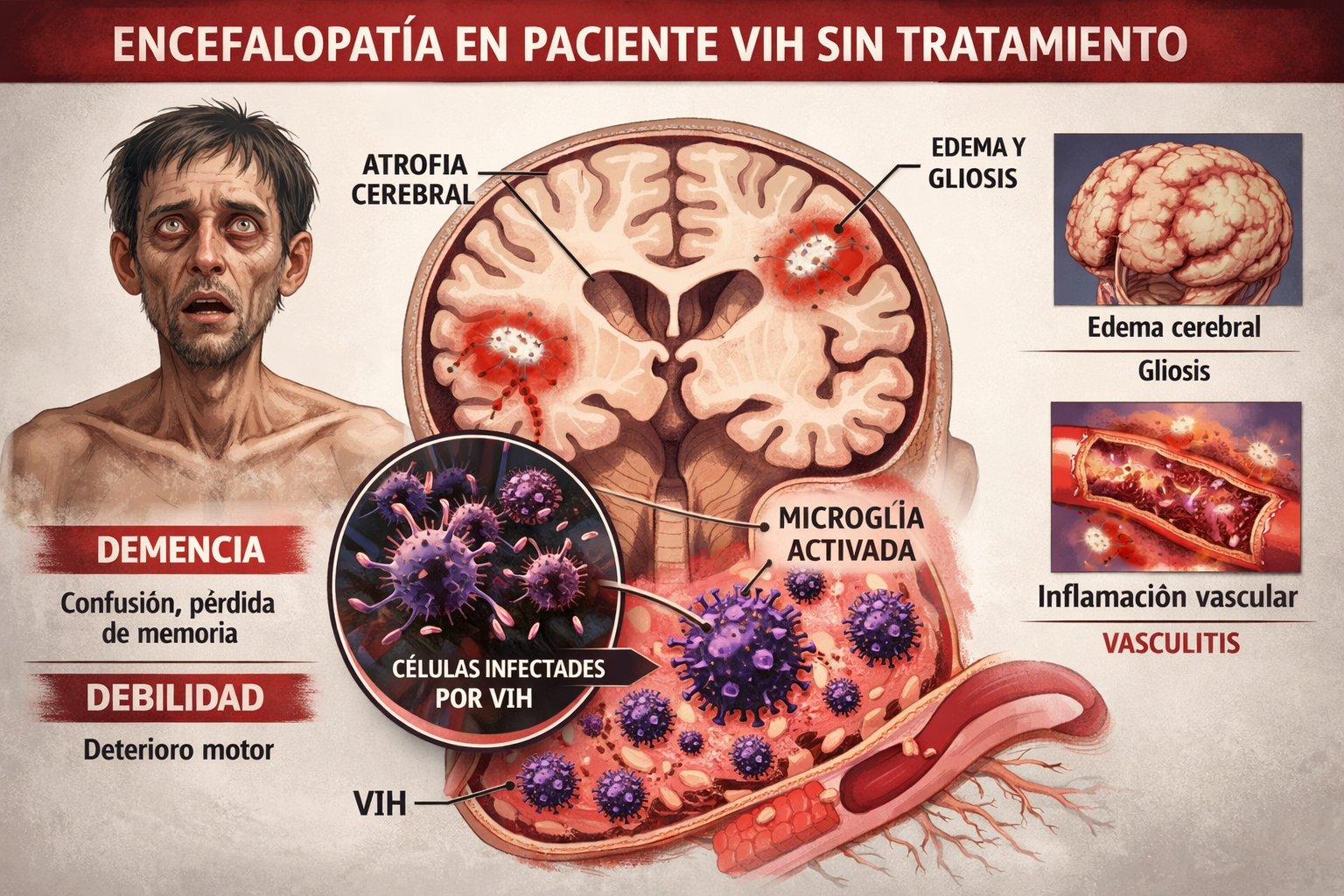
ENCEFALOPATIA POR VIH
En pacientes no tratados la encefalopatía por VIH puede dar alteración de conciencia, pero no suele ser brusca; aun así, puede coexistir con otras causas y estar enmascarado su diagnóstico. La encefalitis por VIH no se produce porque el virus destruya directamente a las neuronas, sino por un mecanismo inflamatorio e inmunológico dentro del SNC.
Poco después de la infección, el VIH atraviesa la barrera hematoencefálica dentro de monocitos infectados. Estos monocitos se transforman en macrófagos perivasculares y microglía infectada. Una vez dentro del cerebro, el VIH infecta preferentemente microglía y macrófagos, no neuronas, provoca activación inmunológica persistente y esas células activadas liberan citocinas proinflamatorias (TNF-α, IL-1β, IL-6), radicales libres, neurotoxinas lo que ocasionan un daño neuronal indirecto. A su vez, la inflamación mantenida produce disfunción sináptica, desmielinización leve, pérdida de sustancia blanca subcortical y atrofia cerebral progresiva. Como resultado de todo este proceso, el cuadro clínico abarca desde un deterioro cognitivo leve hasta encefalopatía por VIH con bradipsiquia, atención alterada, cambios conductuales, trastorno motor y en fases avanzadas estupor y coma.
El pronóstico de estos pacientes varía según el momento de la instauración del TAR, de manera que un tratamiento retroviral de alta eficacia iniciado a tiempo permite la reducción de la carga viral en SNC, disminución de la activación microglial, mejoría del nivel de conciencia en días a semanas y la recuperación cognitiva parcial o incluso casi completa en muchos casos y la progresión suele detenerse. El pronóstico de los pacientes que se instaura TAR en fases avanzadas la mejoría es significativa, pero pueden quedar déficits cognitivos residuales (atención, memoria, velocidad mental). Cuando se inicia el TAR muy tardíamente como es el caso de un coma prolongado o marcada atrofia en la neuroimagen, la reversibilidad es limitada, pudiendo existir daño irreversible con riesgo de complicaciones como deterioro funcional persistente.
ENCEFALITIS POR CMV, WEB Y OTROS HERPESVIRUS
Las infecciones del SNC por virus pueden causar deterioro del nivel de conciencia con TAC normal inicialmente, aunque suele acompañarse de otros déficits neurológicos.
I – Encefalitis por Citomegalovirus (CMV)
El CMV es un herpesvirus β con tropismo por las neuronas, células gliales y endotelio cerebral. En el VIH se produce una reactivación viral por déficit de inmunidad celular (linfocitos T CD4/CD8) con diseminación hematógena al SNC produciendo necrosis neuronal, vasculitis de pequeño vaso y desmielinización. A diferencia de la encefalitis herpética clásica produce una afectación difusa o periventricular, siendo frecuente la asociación con ventriculoencefalitis y radiculomielitis.
Entre sus manifestaciones clínicas destacan el inicio subagudo, el deterioro cognitivo progresivo, la alteración del nivel de conciencia, el déficit focal, convulsiones (poco frecuente), pudiendo coexistir retinitis por CMV y polineuropatía lumbosacra.
El tratamiento se basa:
● Primera línea: Ganciclovir iv, 5 mg/kg IV cada 12 horas, ajustando la dosis según la función renal con una duración de 14-21 días, pudiendo prolongar el tratamiento si existe mala respuesta clínica o PCR positiva persistente en LCR. Como alternativas estaría el foscarnet iv, 60 mg/kg/cada 8 horas o 90 mg/kg/12h, en casos de toxicidad hematológica por ganciclovir o sospecha de cepa resistente; debiendo vigilar la función renal y los iones (Ca, Mg y K). Terapia combinada se recomienda en enfermedad grave o refractaria, alta carga viral en LCR (> 1.000 copias/mL implica carga significativa compatible con enfermedad y > 10.000 copias alta carga viral compatible con enfermedad activa grave) o resistencia antiviral: Ganciclovir iv, 5 mg/kg IV cada 12 horas + Foscarnet iv, 60 mg/kg/cada 8 horas.
● Tratamiento de mantenimiento (profilaxis secundaria). El pacientes VIH y riesgo de recaída se recomienda el valganciclovir oral a dosis de 900 mg cada 12 horas como inducción y posteriormente 900 mg vo cada 24 horas de mantenimiento, debiendo mantener hasta que los CD4 sean > 100-150 cel/ul durante más de 3-6 meses para conseguir la supresión virológica. La profilaxis secundaria ha demostrado que reduce drásticamente la retinitis por CMV, la enfermedad neurológica por CMV y la enfermedad diseminada.
Actualmente, de forma general no se recomienda profilaxis primaria frente al CMV, aunque tengan la serología Ig G positiva frente al CMV, CD4 < 50 cel/ul o alta carga viral plasmática de CMV, fundamentada en que no reduce la mortalidad, no previene de forma eficaz la enfermedad por CMV, tiene alta toxicidad hematológica (neutropenia, anemia y trombocitopenia) y riesgo eficaz de resistencias, considerando la mejor medida profiláctica el TAR.
II – Encefalitis por Virus de Epstein-Barr (VEB)
El VEB es un herpesvirus γ con afinidad por linfocitos B, que en pacientes VIH con niveles de CD4 moderadamente bajos desarrollan una reactivación viral, invasión por el SNC por replicación viral directa con una respuesta inflamatoria perivascular. En este contexto el VEB puede causar una encefalitis aislada o ser responsable del linfoma cerebral primario.
Entre las manifestaciones clínicas destacan el curso subagudo, la cefalea persistente, la fiebre, alteraciones cognitivas y conductuales, déficits focales, convulsiones, etc. En la RMN cerebral puede observarse lesiones mal definidas.
● No existe tratamiento retroviral especifico altamente eficaz, por lo que no están recomendados de rutina el aciclovir o ganciclovir. El motivo fundamental es que el VEB en fase latente no expresa timidina-quinasa por lo que la replicación viral no se inhibe eficazmente y no existe evidencia solida de mejoría clínica ni pronostica. El manejo se basa en la optimización del TAR con el fin de obtener un control de la replicación viral mejorando la inmunidad aumentando los niveles de CD4 y la supresión de carga viral del VIH. El momento de la instauración del TAR generalmente es entre la 1-2 semanas debiendo vigilar el SIRI neurológico.
● Por otro lado, es fundamental el control de la inflamación cerebral con corticoides, que, a diferencia de otras encefalitis virales, cuando existe edema cerebral significativo, hipertensión intracraneal, deterioro neurológico progresivo, encefalitis mediada por respuesta inmune o vasculitis asociada son altamente eficaces. La duración no está estandarizada, y se basa en criterios clínicos y radiológicos. En la práctica clínica la duración habitual vería entre 7-14 días, incluyendo la retirada progresiva, pudiendo reducir o suspenderlos ante una rápida mejoría clínica, disminución del edema en RMN/TC, sospecha de infección concomitante no controlada, y aparición de efectos adversos graves (hiperglucemia, infección secundaria, delirium, etc.)
Se recomienda la dexametasona a dosis de 4-10 mg iv cada 4-8 horas. Como alternativa se puede usar metilprenisolona 1 g iv durante 3-5 días en cuadros graves o refractarios, con descenso posterior progresivo.
● Inmunoglobulinas intravenosas. Su uso es excepcional, debiendo considerarlas en encefalitis grave refractaria, sospecha de mecanismo inmunomediado, en pacientes con hipogammaglobulinemia o pediátricos. Dosis recomendada: 0,4 g/kg/día iv durante 5 días
● Tratamiento de soporte neurológico.
- Control de convulsiones: Levetiracepam 500-1500 mg cada 12 horas
- Manejo de la hipertensión endocraneal
- Soporte orgánico, intubación conexión a ventilación mecánica, etc.
- Rehabilitación neurológica precoz
● La sospecha de linfoma cerebral primario requiere de biopsia con el fin de instaurar un tratamiento oncohematológico especifico.
III – Encefalitis por otros herpesvirus:
III-I – Virus Herpes Simple tipo 1 y 2 (HSV-1 / HSV-2)
La reactivación viral con invasión del SNC suele tener trofismo por el lóbulo temporal y el sistema límbico que en el paciente VIH se traduce con mayor extensión, mayor carga viral y mayor respuesta inflamatoria.
Entre las manifestaciones clínicas destacan el inicio agudo, la fiebre, alteración del nivel de conciencia, convulsiones (frecuentes), afasia, cambios conductuales.
La TC puede mostrar aumento densidad en lóbulos temporales, y la RMN puede mostrar lesiones temporales hemorrágicas. Es típico el patrón punta-onda temporal en el EEG.
El tratamiento se basa en aciclovir intravenoso 10 mg/kg (peso ideal, especialmente en obesos) iv cada 8 horas, a pasar en 1 horas con una duración de 14-21 días (pauta indicada en VHS1, VHS2, VZV y en meningitis viral grave o en inmunodeprimidos). Tras la mejoría clínica y estabilidad se debe pasar a valaciclovir 1.000 mg cada 8 horas hasta completar una duración total de 10-14 días. Se recomienda TAR precoz tras la estabilización.
III-II – – Virus Varicela-Zóster (VVZ)
La meningitis por VVZ se produce por reactivación ganglionar y diseminación al SNC, siendo responsable de la encefalitis, vasculopatía cerebral y del riesgo de infartos isquémicos y hemorrágicos. Entre las manifestaciones clínicas destacan la encefalopatía, déficits focales, ictus en pacientes jóvenes. El tratamiento se basa en aciclovir intravenoso 10 mg/kg (peso ideal, especialmente en obesos) iv cada 8 horas, a pasar en 1 horas con una duración de 14-21 días (pauta indicada en VHS1, VHS2, VZV y en meningitis viral grave o en inmunodeprimidos). Tras la mejoría clínica y estabilidad se debe pasar a valaciclovir 1.000 mg cada 8 horas hasta completar una duración total de 10-14 días. Los corticoides pueden ser útiles en vasculitis seleccionadas. Se recomienda TAR precoz tras la estabilización.
Precauciones con el uso de aciclovir
| Ajuste de dosis de aciclovir según función renal | |
| Aclaramiento (ClCr (mL/min) | Dosis |
| > 50 | 10 mg/kg cada 8 horas |
| 25 – 50 | 10 mg/kg cada 12 horas |
| 10 – 25 | 10 mg/kg cada 24 horas |
| < 10 | 5-10 mg/kg cada 24 horas |
El aciclovir puede producir toxicidad renal aguda, y la hidratación adecuada junto con la monitorización de la función renal son las medidas clave para prevenirla y detectarla precozmente.
El aciclovir tiene una eliminación fundamentalmente renal (filtración glomerular y secreción tubular) y al alcanzar altas concentraciones en el túbulo renal, puede precipitar. El aciclovir tiene escasa solubilidad en orina sobre todo en orinas concentradas y con la existencia de un flujo tubular bajo de manera que la formación de cristales intratubulares producen obstrucción tubular, pudiendo producir un aumento brusco de la creatinina e insuficiencia renal aguda. Este daño puede aparecer en 24-48 horas tras iniciar el tratamiento, siendo más frecuente con altas dosis iv, infusión rápida o deshidratación. Además, la cristaluria puede ocasionar nefritis intersticial aguda que se asocia a eosinofilia, fiebre y exantema (poco frecuente) o necrosis tubular aguda secundaria a isquemia tubular y obstrucción tubular prolongada. En este sentido, la administración de aciclovir requiere una hidratación adecuada con el fin de aumentar el flujo urinario, disminuir la concentración tubular de aciclovir, evitar la precipitación de cristales y reducir el riesgo de fracaso renal agudo. Se debe evitar los estados de hipovolemia, una correcta hidratación y asegurar una diuresis ≥ 100-150 ml/h
Actualmente la alcalinización de la orina con bicarbonato no se recomienda de forma rutinaria junto con la hidratación para prevenir la toxicidad del aciclovir, en la medida que esta medida al alcalinizar la orina aumentaría la solubilidad del aciclovir y disminuiría la precipitación de cristales en el túbulo renal (por analogía con otros fármacos como el metotrexato), pero en la actualidad no existe una evidencia solida que demuestre que exista una menor incidencias de FRA o un mejor aclaramiento del fármaco; por ello las guías no recomiendan el bicarbonato como uso sistemático, además su uso puede causar alcalosis metabólica, hipernatremia, hipocalcemia, sobrecarga de volumen y dificultad en el control hidroelectrolítico.
CRISIS EPILÉPTICAS NO CONVULSIVAS / ESTADO EPILÉPTICO NO CONVULSIVO
En un paciente entra en coma, pero la exploración neurológica y el TAC pueden ser normales, el EEG es fundamental para descartar la existencia de crisis o estatus epiléptico no convulsivo. La existencia de fluctuaciones y recuperaciones rápidas pueden orientar esta situación.
La crisis epiléptica no convulsiva (CENC) hace referencia a la existencia de una actividad epiléptica sin manifestaciones motoras evidentes y suele manifestarse como alteración del nivel de conciencia, confusión, delirio persistente y deterioro cognitivo agudo. El estado epiléptico no convulsivo (EENC) hace referencia a la existencia de una actividad epiléptica continua o recurrente (≥ 10 – 30 minutos) sin recuperación completa de la conciencia.
1 – FISIOPATOLOGIA
En el paciente VIH la fisiopatología es multifactorial, resultado de la interacción entre el daño estructural, inflamación, infección y toxicidad.
1 – Por un lado, el daño cerebral estructural (sustrato epileptógeno) es frecuente en el VIH consecuencia de infecciones oportunistas del SNC (Toxoplasmosis, CMV, HSV / VZV, VEB, PML), tumores (linfoma primario del SNC), o de secuelas (gliosis, necrosis y calcificaciones). Estas lesiones generan hiperexcitabilidad cortical crónica.
2 – Además, la inflamación neuroinmunológica con activación persistente de la microglía y astrocitos que condicionarán la liberación de mediadores proinflamatorios y excitadores (IL-1β, TNF-α, Glutamato) provocando la alteración de la barrera hematoencefálica, disminuyendo el umbral convulsivo, facilitando descargas epileptiformes sin expresión motora.
3 – A su vez, la infección directa por VIH (HAND) puede producir encefalopatía asociada al VIH cuya neurotoxicidad indirecta, disfunción sináptica y alteración de las redes inhibitorias (GABA) favorecen las crisis no convulsivas difusas.
4 – Trastornos metabólico tóxicos. En el VIH avanzado es frecuente alteraciones metabólicas como la hipoglucemia, hiponatremia, insuficiencia renal/hepática, sepsis, fármacos (Efavirenz, Isoniacida, metronidazol, aciclovir (neurotoxicidad), SIRI neurológico, facilitan el EENC sin foco estructural claro.
2 – MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas frecuentemente sutiles en forma de alteración del nivel de conciencia fluctuante, confusión persistente, mutismo, desorientación, automatismos mínimos (parpadeo, mirada fija) o falta de respuesta a estímulos por ello para su diagnóstico el EEG es imprescindible.
3 – TRATAMIENTO
El tratamiento sigue los principios generales del estado epiléptico, con consideraciones específicas en VIH.
El tratamiento inicial (fase urgente) se basa en la administración de benzodiacepinas (primera línea) vía intravenosa: Lorazepam 0,1 mg/kg (max 4 mg), pudiendo repetirse una vez, diazepam 10 mg iv o midazolam iv/im si no hay vía venosa canalizada. El tratamiento de segunda línea se basa en los antiepilépticos que en el paciente VIH el de elección es el levetiracetam (no tiene interacciones con el TAR, no presenta hepatotoxicidad y es bien tolerado) a dosis de carga 1.000-3.000 mg iv con un mantenimiento de 1.000 – 1.500 mg iv/vo cada 12 horas. Como alternativas /cuando el levetiracepam no es suficiente o no está disponible), debiendo usarse con precaución, se dispone de valproato (se debe evitar en caso de hepatopatía, coinfección con VHB/VHC, trombopenia) siendo la dosis de carga 20-40 mg/kg iv (máximo habitual 3.000 mg) en 10-15 minutos dejando de mantenimiento 15-60 mg/kg/día repartido en 8-12 horas siendo la dosis frecuente 500 – 1.000 iv/vo cada 8 – 12 horas. Debiendo solicitar niveles plasmáticos con un rango terapéutico entre 50-100 ug/ml, reviendo monitorizar durante su administración transaminasas (amonio, si hay deterioro neurológico), y plaquetas.
La lacosamida (mínimas interacciones con TAR y bien tolerado) se administra en dosis de carga 200 – 400 mg administrándose en 15 – 30 minutos, siendo la dosis más utilizada en UCI 400 mg iv en dosis única y posteriormente de mantenimiento 100 – 200 mg cada 12 horas.
Se deben considerar ajustes y precauciones en:
- Insuficiencia renal grave, siendo la dosis máxima 300 mg
- Insuficiencia hepática moderada, no superando los 300 mg/día
- Hay que tener en cuenta que la lacosamida puede prolongar el PR, por lo que se recomienda evitar en pacientes con bloqueos AV avanzados.
Se debe evitar la fenitoína no solo trata mal las crisis en el VIH: puede desestabilizar el tratamiento antirretroviral y empeorar el pronóstico global del paciente.
- Mayor ineficacia terapéutica
- Múltiples interacciones con TAR, pues es un potente inductor del citocromo P450 provocando la disminución de concentraciones de múltiples retrovirales (inhibidores de la proteasa, inhibidores no nucleósidos como el efavirenz o la nevirapina, algunos inhibidores de la integrasa) condicionando el fracaso virológico y aumentando el riesgo de aparición de resistencias.
- Dificultad para alcanzar niveles terapéuticos, pues pequeños cambios de dosis presentan grandes variaciones plasmáticas y en el VIH esta circunstancia se ve aumentado por la frecuencia de hipoalbuminemia, hepatopatía y la polifarmacia que sueles requerir estos pacientes.
- Mayor riesgo de toxicidad con nistagmus, ataxia y encefalopatía que en el VIH puede simular o agravar la encefalopatía, dificultando el diagnostico diferencial del EENC.
- Mayores riesgos de hepatotoxicidad e inmunodepresión pudiendo empeorar la coinfección VHB/VHC, daño hepático y causar linfopenia y alteración de la respuesta inmune.
- Peor perfil de seguridad con mayor riesgo de arritmias (sobre todo en infusiones rápidas), hipotensión y necrosis tisular en caso de extravasación.
TROMBOSIS VENOSA CEREBRAL (TVC)
Los pacientes con VIH tienen un riesgo aumentado de enfermedad tromboembólica, incluida la trombosis venosa cerebral, incluso en edades jóvenes. Entre los factores de riesgo específicos que se han relacionado con este aumento del riesgo se encuentran:
- Relacionados con el virus, consecuencia de la replicación viral activa, inmunosupresión (CD4 bajos) y la consecuente activación inflamatoria crónica.
- Relacionados con el tratamiento, como son el TAR (especialmente inhibidores de la proteasa), interacciones farmacológicas, dislipemia e insulinorresistencia que condicionan.
- Relacionados con comorbilidades (infecciones oportunistas, neoplasias (linfoma), deshidratación, uso de corticoides, sepsis, hospitalización prolongada, sedentarismo, etc.)
1 – FISIOPATOLOGÍA
La Trombosis Venosa Cerebral (TVC) en el VIH es el resultado de una hipercoagulabilidad adquirida multifactorial, que afecta los tres elementos de la tríada de Virchow.
1 – Por un lado, estos pacientes presentan un estado de hipercoaguabilidad condicionado por la disminución de Proteína S (la más característica en VIH), ↓ Proteína C, ↓ Antitrombina III, y el aumento del factor VIII y fibrinógeno. Además, la presencia de anticuerpos antifosfolípidos y anticoagulante lúpico favorecen la trombosis venosa, incluida la cerebral.
2 – Inflamación endotelial crónica. La activación persistente del endotelio por el VIH y las citocinas inflamatorias (IL-6, TNF-α) inducen la disfunción endotelial provocando el aumento de la expresión de factor tisular y disminución de la producción de óxido nítrico, facilitando la formación del trombo en senos venosos cerebrales.
3 – Infecciones oportunistas del SNC, especialmente tuberculosis, CMV, VZV, meningitis bacteriana o fúngica que favorecen la vasculitis, compresión de senos venosos y extensión inflamatoria local.
2 – MANIFESTACIONES CLINICAS
La clínica es inespecífica y solapada con otras patologías del SNC en VIH lo que puede ser difícil su diagnóstico. Los síntomas más frecuentes son la cefalea progresiva (el más frecuente), las crisis epilépticas (convulsivas o no), el déficit neurológico focal, alteración del nivel de conciencia, papiedema, náuseas/vómitos; siendo síntomas de alta sospecha la cefalea persistente no explicada, la aparición de crisis epilépticas de nueva aparición y el empeoramiento neurológico subagudo.
3 – DIAGNOSTICO
La prueba de elección es la RMN cerebral junto con la venografía (angio-RMN) que pone de manifiesto la ausencia de flujo en senos venosos, infartos venosos, hemorragias parenquimatosas atípicas y edema vasogénico. Alternativamente (cuando no se dispone de RMN) es el TC + angio-TC venosa. El TAC sin contraste suele ser normal.
Estudios complementarios: Hemograma, coagulación, niveles de proteína C, S y AT III (interpretar con cautela los niveles de proteínas C, S y antitrombina III en pacientes con VIH porque con frecuencia están disminuidos de forma secundaria y transitoria, sin representar una trombofilia hereditaria real) y anticuerpos antifosfolípidos.
4 – TRATAMIENTO
El tratamiento es similar al de la población general, con consideraciones específicas en los pacientes VIH, siendo la anticoagulación el pilar del mismo. En fase aguda se recomienda heparina de bajo peso molecular (enoxaparina 1 mg/kg SC cada 12 h).Alternativamente se puede usar heparina no fraccionada IV (si riesgo hemorrágico o insuficiencia renal). La presencia de hemorragia venosa NO contraindica anticoagulación.
1 – Heparina sódica. Las principales indicaciones de anticoagulación con heparina sódica en el paciente con trombosis venosa cerebral son la coexistencia de insuficiencia renal grave, elevado riesgo hemorrágico elevado (por su rápida reversibilidad) y la necesidad de realización de procedimientos invasivos.
Esquema estándar de perfusión intravenosa:
● Bolo inicial (opcional): 70–80 UI/kg IV (Máx. habitual: 5.000 UI), debiendo evitar el bolo en los casos de hemorragia intracraneal o riesgo hemorrágico alto.
● Perfusión continua: 15–18 UI/kg/h IV, siendo la dosis inicial orientativa en un adulto medio 1.000–1.200 UI/h
Preparación: 25.000 UI en 250 mL de suero fisiológico (Concentración final: 100 UI/mL). Ajustar siempre según: TTPa (1,5–2,5× control) o anti-Xa (0,3–0,7 UI/mL) si TTPa no fiable. Revalorar dosis cada 6 h tras cambios.
| Peso paciente (kg) | Dosis objetivo (UI/kg/h) | UI/h aproximadas | Velocidad (mL/h) |
| 50 kg | 18 UI/kg/h | 900 UI/h | 9 mL/h |
| 60 kg | 17 UI/kg/h | 1.020 UI/h | 10 mL/h |
| 65 kg | 16–17 UI/kg/h | 1.040–1.105 UI/h | 10–11 mL/h |
| 70 kg | 15–17 UI/kg/h | 1.050–1.190 UI/h | 10,5–12 mL/h |
| 75 kg | 15–16 UI/kg/h | 1.125–1.200 UI/h | 11–12 mL/h |
| 80 kg | 15 UI/kg/h | 1.200 UI/h | 12 mL/h |
| 90 kg | 15 UI/kg/h | 1.350 UI/h | 13,5 mL/h |
| 100 kg | 15 UI/kg/h | 1.500 UI/h | 15 mL/h |
* Con heparina 25.000 UI en 250 mL, pensar en “10–12 mL/h” cubre a la mayoría de adultos para anticoagulación terapéutica inicial.
¿A quién solicitar niveles de anti-Xa?
No se debe solicitar de rutina los niveles de anti-Xa para todos los pacientes que reciben tratamiento con heparina. Las principales ventajas del anti-Xa frente al TTPa es que este último se ve afectado por inflamación, esta influido por el factor VIII y es variable interlaboratorio, mientras que los niveles de anti Xa mide el efecto real de la heparina, es más específico y más reproducible. Por tanto, en el paciente VIH con activación inflamatoria el anti-Xa es más fiable que el TTPa, siendo recomendable en situaciones especiales:
- TTPa no fiable o discordante
- Inflamación intensa (fase aguda)
- VIH avanzado
- Sepsis
- Lupus anticoagulante
- Factor VIII elevado
- Embarazo
- Obesidad mórbida
- Sospecha de resistencia a heparina
- Falta de correlación TTPa–clínica
¿Cuándo se deben solicitar niveles?
El momento de extracción del anti-Xa es clave para que el resultado sea interpretable.
● Cuando se usa heparina sódica (no fraccionada) se deben solicitar los niveles a las 6 horas de iniciar la perfusión continua y ante cualquier cambio de dosis o bien si se reinicia la perfusión tras una interrupción significativa. Se solicita a las 6 horas porque entre las 4-6 horas la HNF alcanza su estado estable y si se extrae antes, el anti-Xa infraestima el efecto real. El rango terapéutico con HNF: anti-Xa (0,3–0,7 UI/mL)
● Cuando se usa heparina de bajo peso molecular (HBPM)
Objetivo terapéutico con anti-Xa (HNF): 0,3–0,7 UI/mL los niveles se deben solicitar a las 4 horas de la administración subcutánea con el fin de medir el pico plasmático, generalmente tras la 3 – 4 dosis.
El rango terapéutico dependerá de la dosis administrada: 0,6–1,0 UI/mL (cada 12 h) o 1,0–2,0 UI/mL (cada 24 h). Los niveles se deben solicitar a las 4 horas de la administración subcutánea con el fin de medir el pico plasmático, generalmente tras la 3 – 4 dosis.
| Monitorización de anticoagulación con heparina según niveles de anti-Xa | ||
| Tipo de heparina | Momento de niveles | Objetivo |
| HNF | tras inicio o ajuste de perfusion | 0,3–0,7 UI/mL |
| HBPM (cada 24 horas) | 4 h post-dosis (pico) | 1,0–2,0 UI/mL |
| HBPM (cada 12 horas) | 4 h post-dosis (pico) | 0,6–1,0 UI/mL |
| Ajuste de dosis según niveles de anti-Xa en la administración de heparina sódica (HNF) | |||
| Anti-Xa (UI/mL) | Interpretación | Modificación de dosis | Cuando repetir anti-Xa |
| < 0,2 | Muy infraterapéutico | Aumentar +4 UI/kg/h | 6 h |
| 0,2 – 0,29 | Infraterapéutico | Aumentar +2 UI/kg/h | 6 h |
| 0,3 – 0,7 | Terapéutico | Mantener dosis | 24 h |
| 0,71 – 1,0 | Supraterapéutico leve | Disminuir −2 UI/kg/h | 6 h |
| > 1,0 | Supraterapéutico alto | Suspender 1 h y reiniciar con −3 a −4 UI/kg/h | 6 h |
| Ajuste de dosis con pauta 1 mg/kg cada 12 h según niveles de anti-Xa en la administración de heparina de bajo peso molecular (HBPM) – Enoxaparina. | |||
| Anti-Xa (UI/mL) | Interpretación | Modificación de dosis | Nuevo control |
| < 0,4 | Muy infraterapéutico | Aumentar +20 % | 4 h tras 3 dosis |
| 0,4 – 0,59 | Infraterapéutico | Aumentar +10 % | 4 h tras 3 dosis |
| 0,6 – 1,0 | Terapéutico | Mantener dosis | Solo si cambia clínica |
| 1,01 – 1,2 | Ligeramente alto | Reducir −10 % | 4 h tras 3 dosis |
| > 1,2 | Supraterapéutico | Reducir −20 % o suspender 1 dosis | 4 h tras 3 dosis |
| Ajuste de dosis con pauta 1,5 mg/kg cada 24 h según niveles de anti-Xa en la administración de heparina de bajo peso molecular (HBPM) – Enoxaparina. | ||
| Anti-Xa (UI/mL) | Interpretación | Modificación de dosis |
| < 0,8 | Bajo | Aumentar +10–20 % |
| 1,0 – 2,0 | Terapéutico | Mantener |
| > 2,0 | Alto | Disminuir −20 % |
¿Se debe medir el anti Xa si se usa fondaparinux a dosis anticoagulantes?
NO es útil de forma rutinaria los niveles de anti Xa cuando se usa fondaparinux, debido a que el mecanismo es distinto, pues inhibe exclusivamente al factor Xa y no se une a la trombina, su efecto es predecible, dosis-dependiente y lineal. Por tanto, no requiere monitorización rutinaria.
| Prescripción segura del fondaparinux | |
| Peso | Dosis terapéutica |
| < 50 kg | 5 mg SC cada 24 h |
| 50–100 kg | 7,5 mg SC cada 24 h |
| > 100 kg | 10 mg SC cada 24 h |
El fondaparinux esta contraindicado en casos de disfunción renal con ClCr <30 mL/min, debiendo usar con cautela en los casos de ClCr 30–50 mL/min.
SINDROME DE RESPUESTA INFLAMATORIA (SIRI) NEUROLOGICO
El SIRI neurológico es una respuesta inflamatoria exagerada en el sistema nervioso central que aparece tras el inicio o intensificación del tratamiento antirretroviral (TAR) en pacientes con VIH, como consecuencia de la recuperación parcial de la inmunidad celular frente a patógenos presentes o antígenos residuales en el SNC. No se trata de una infección nueva, sino una respuesta inmune desproporcionada.
1 – FISIOPATOLOGÍA
El SIRI neurológico es el resultado de la interacción de tres mecanismos clave:
1. Recuperación brusca de la inmunidad celular.
El TAR reduce rápidamente la carga viral del VIH, aumenta la función y el número de linfocitos CD4 y restablece la capacidad de respuesta TH1, de manera que el sistema inmune vuelve a reconocer antígenos previamente “silenciosos” en el SNC.
2. Persistencia de antígenos en el SNC
Por otro lado, en el SNC pueden persistir microorganismos viables (CMV, TB, Criptococcus), restos antigénicos o lesiones estructurales previas, lo que implica una respuesta inflamatoria local con el desarrollo de una tormenta inflamatoria local que incluye la activación intensa de microglía, astrocitos y linfocitos CD8 con la liberación de IFN-γ, TNF-α, IL-6, junto con el aumento de la permeabilidad de la barrera hematoencefálica produciendo el aumento del edema cerebral, efecto masa y desmielinización.
Entre los factores de riesgo relacionados para su desarrollo destacan:
- CD4 muy bajos al iniciar TAR (<50–100 cél/µl)
- Alta carga viral VIH
- Inicio precoz del TAR tras infección oportunista del SNC
- Infecciones con alta carga antigénica: tuberculosis, criptococosis, CMV, toxoplasmosis
2 – MANIFESTACIONES CLINICAS
Los síntomas son muy variables, y abarcan desde síntomas generales (empeoramiento neurológico paradójico, cefalea intensa, fiebre (no siempre), deterioro del nivel de conciencia), manifestaciones focales (déficits neurológicos focales, crisis epilépticas que pueden ser convulsivas o no, hipertensión intracraneal y aumento del edema perilesional).
Los síntomas pueden aparecer entre 2-12 semanas tras iniciar el TAR y puede aparecer antes en infecciones del SNC, por ello es importante la realización de una punción lumbar en los pacientes con VIH, alteración del nivel de conciencia y recuento de CD4 inferiores a 250.
3 – DIAGNÓSTICO
La prueba diagnóstica clave es la RMN cerebral cuyos hallazgos típicos son el aumento del edema, realce inflamatorio intenso, efecto masa con lesiones que “crecen” pese al control microbiológico, siendo un patrón inflamatorio más llamativo que infeccioso. En el LCR (PL) puede encontrarse pleocitosis inflamatoria, proteínas elevadas con cultivos negativos o negativicen de los mismos. Hallazgos que sugiere inflamación más que infección.
4 – DIAGNÓSTICO DIFERENCIAL
El SIRI neurológico debe de diferenciarse de:
- Fracaso del tratamiento de la infección oportunista
- Nueva infección del SNC
- Toxicidad farmacológica
- Linfoma primario del SNC
5 – TRATAMIENTO
El tratamiento del SIRI neurológico se basa en NO suspender el TAR, salvo en riesgo vital), tratar y completar el tratamiento de la infección oportunista y controlar la inflamación cerebral.
Corticoides. Los corticoides son el pilar del tratamiento, estado indicados en caso de edema cerebral, deterioro neurológico progresivo, hipertensión endocraneal o crisis epilépticas asociadas a edema. Pudiendo usarse dexametasona 4-8 mg iv cada 6-8 horas y en casos graves metilprednisona 1 g iv durante 3-5 dias con posterior descenso gradual de ambos corticoides. La duración total recomendada es entre 2-6 semanas con retirada gradual.
Tratamiento sintomático: Antiepilépticos (levetiracepam de elección) manejo de la HIC, soporte en UCI en caso necesario.
6 – PRONÓSTICO
El pronostico varia según el patógeno implicado, la rapidez en el diagnostico, la gravedad del edema que pueden dejar secuelas neurológicas, epilepsia secundaria con una mortalidad elevada si no se reconoce precozmente.