Luis A. Pallás Beneyto. Unidad de Cuidados Intensivos. Hospital Lluís Alcanyís Xàtiva (Valencia). España

| INTRODUCCION |
El Estado Epiléptico Refractario de Nueva Aparición (NORSE) es una condición neurológica rara y grave en la que un paciente sin antecedentes de epilepsia ni otros problemas neurológicos, desarrolla un estado epiléptico refractario (que no responde a las terapias estándar), caracterizándose por la ausencia de una causa estructural, tóxica o metabólica aguda o activa clara.
Las principales características del NORSE incluyen:
● Ausencia de antecedentes de epilepsia. El paciente no tiene historia previa de convulsiones o epilepsia.
● Estado epiléptico refractario. Las convulsiones no responden a las terapias estándar, como los fármacos anticonvulsivos.
● Ausencia de causas claras. No se identifica una causa estructural, tóxica o metabólica que explique el estado epiléptico.
● Elevada mortalidad e impacto neurológico. El NORSE puede tener un alto riesgo de mortalidad y complicaciones neurológicas a largo plazo.
● Posibles etiologías. Aunque en algunos casos se identifica la causa, en otros permanece desconocida. Se han identificado causas como infecciones (especialmente la febril relacionada con encefalitis), encefalitis autoinmunes, alteraciones genéticas y otros factores.
Consideraciones adicionales:
● El NORSE es un diagnóstico clínico, no una entidad patológica específica.
● El diagnóstico y tratamiento del NORSE requieren una evaluación cuidadosa y multidisciplinaria.
● La detección y tratamiento tempranos son fundamentales para mejorar el pronóstico.
● Se necesita investigación adicional para comprender mejor las causas, el tratamiento y el pronóstico del NORSE.
| DEFINICIÓN |
Un consenso de expertos reunido en 2017 estandarizó el concepto de NORSE, con la finalidad de facilitar el reconocimiento y tratamiento precoces del mismo. Esta entidad se definió como: “una presentación clínica, y no un diagnóstico específico, en un paciente sin epilepsia activa u otro desorden neurológico relevante, que presenta un Estatus Epiléptico Refractario (EER) de nueva aparición sin una clara causa estructural, tóxica o metabólica aguda o activa”. Esta definición no excluye pacientes con daño cerebral remoto o epilepsia resuelta. Asimismo, se incluyen pacientes con infecciones virales del sistema nervioso central (SNC) o síndromes autoinmunes, como la encefalitis por anticuerpos anti-NMDA. Los casos en que, tras un extenso proceso diagnóstico, no se evidencia la causa del NORSE son clasificados como NORSE criptogénico o de etiología desconocida.
Este mismo consenso, intentó normalizar la definición del Síndrome Epiléptico relacionado con infección febril (FIRES por sus siglas en inglés: Febrile Infection-Related Epilepsy Syndrome), que clásicamente se había considerado una condición análoga al NORSE, pero de presentación en edad pediátrica. El consenso definió el FIRES como una subcategoría del NORSE que aplica a todas las edades y que requiere una infección febril previa, con inicio del síndrome febril 2-4 semanas previo al comienzo del EER, con o sin presencia de fiebre en el momento de inicio de las CE.
| EPIDEMIOLOGÍA |
El NORSE es una entidad infrecuente, que afecta principalmente a adultos jóvenes y niños en edad escolar, con un segundo pico de frecuencia sobre los 60 años. Su incidencia no está bien establecida, pero según diversas series podría abarcar el 10-20% de casos de EER; correspondiendo en su mayor parte a Estatus Epilépticos súper-refractarios (EESR), definidos como la persistencia o recurrencia del EE tras 24 horas de tratamiento con fármacos anestésicos.
La mayoría de estudios en adultos han mostrado que el NORSE es más prevalente en mujeres, mientras que en población pediátrica se ha visto un predominio de frecuencia en varones. Por otro lado, no se han registrado diferencias étnicas en estos pacientes ni se han publicado, hasta el momento, casos con distribución familiar.
| FISIOPATOLOGÍA |
Se ha propuesto la presencia de un mecanismo inmune/inflamatorio como eje de la fisiopatología del NORSE. Este mecanismo se basa en la hiperproducción de citoquinas inflamatorias con actividad pro-convulsiva como la principalmente IL-6, IL-8 y CXCL10, según los hallazgos de suero y líquido cefalorraquídeo (LCR) de pacientes con FIRES.
Se ha teorizado que la respuesta inflamatoria desencadenada tras una noxa inicial, como un proceso infeccioso, podría dar paso a la activación de la inmunidad innata dentro del SNC y la consecuente neuroinflamación que sería clave para la epileptogénesis, a través de la reducción del umbral epileptogénico producto de alteraciones en diversos canales iónicos y en la liberación/recaptación de neurotransmisores como el glutamato. Además, la propia actividad epiléptica podría contribuir a mantener dicha neuroinflamación, originando un ciclo que favorecería la persistencia de las Crisis Epilépticas (CE).
| ETIOLOGÍA |
Tras un estudio diagnóstico extenso, se consigue establecer una causa aproximadamente en la mitad de los pacientes adultos con NORSE. En el NORSE de etiología conocida, la causa más frecuente está comprendida por las encefalitis autoinmunes, tanto paraneoplásicas como idiopáticas, en un 40% de los casos, siendo los anticuerpos contra el receptor anti-NMDA y contra el canal de potasio dependiente de voltaje los más frecuentemente reportados.
Las encefalitis infecciosas abarcan cerca del 10% de pacientes con NORSE, producidas por agentes como el virus de Epstein-Barr, virus de la varicela-zoster o Mycoplasma pneumoniae.
Otras etiologías mucho más raras incluyen cuadros genéticos, neoplásicos – como la carcinomatosis leptomeníngea – o de origen tóxico-metabólico.
| MANIFESTACIONES CLINICAS |
En el curso clínico del NORSE pueden identificarse 3 fases: prodrómica, aguda y crónica. Estas fases no son siempre sucesivas y pueden solaparse a lo largo de la evolución.
● Fase prodrómica
La fase prodrómica precede al inicio de las CE en un rango habitual de 1-14 días, aunque se han registrado casos en las que esta fase inicia hasta 30 días antes. En un 60% de los casos de NORSE con etiología identificada y 90% de los casos de causa desconocida, esta fase se ve caracterizada por síntomas inespecíficos pseudogripales, gastrointestinales o de vías respiratorias superiores, pudiendo estar los pacientes asintomáticos durante algunos días entre el comienzo de esta clínica y el de la fase aguda del NORSE. También se han comunicado síntomas psiquiátricos como parte de esta fase prodrómica, siendo las alucinaciones las más frecuentes, sobre todo en casos secundarios a encefalitis autoinmune. Además, se puede objetivar fiebre, en hasta la mitad de los pacientes con NORSE, siendo un síntoma definitorio en los casos de FIRES.
● Fase aguda
La fase aguda viene caracterizada por el inicio y empeoramiento progresivo de las CE junto con deterioro del nivel de consciencia, pudiendo durar esta etapa desde pocos días hasta varios meses. En primera instancia, las crisis suelen ser breves e infrecuentes; pero, a menudo en las primeras 24 horas, aumentan de manera drástica en frecuencia, habiéndose reportado desde docenas hasta cientos de crisis/día en niños con FIRES, y evolucionando a un EER con la totalidad de los pacientes, requiriendo ventilación mecánica y estancia prolongada en unidades de vigilancia intensiva y con un 75% evolucionando a EESR.
Los casos de NORSE criptogénico se han asociado a mayor refractariedad al tratamiento. El tipo de CE más frecuente son las crisis focales (CF) con/sin progresión a tónico-clónica bilateral, con una semiología diversa que va desde CF motoras hasta crisis mioclónicas o autonómicas.
● Fase crónica
A diferencia de lo que sucede con la fase prodrómica, en la que el paciente puede estar algunos días asintomático hasta iniciar las CE, en este caso no existe período libre entre la fase aguda y la fase crónica en la que el desarrollo de epilepsia farmacorresistente y deterioro neurológico son las características principales. Entre el 75 y el 90% de sujetos que alcanzan la fase crónica del NORSE desarrollan epilepsia farmacorresistente, requiriendo una mediana de 3 FAC para su tratamiento e inmunoterapia crónica en hasta un cuarto de los casos. Por otro lado, casi la mitad de sujetos presentan deterioro cognitivo, la mayoría en grado leve-moderado, el mismo que se ha asociado a una edad más temprana de presentación y a mayor duración del coma inducido en brote-supresión como parte del tratamiento del EER. Otras manifestaciones a largo plazo incluyen las alteraciones del comportamiento y el déficit motor relacionado con neuropatía periférica producto de la hospitalización prolongada
| DIAGNÓSTICO |
Hasta el momento, no existe una prueba complementaria única o algún biomarcador específico que permita identificar los pacientes con NORSE, lo que lleva, habitualmente, a un retraso diagnóstico. El abordaje diagnóstico se basa en las características clínicas del paciente y en una serie de pruebas que permitan descartar causas habituales de EER y buscar la causa del NORSE.
Se recomienda que las pruebas iniciales se realicen en las primeras 24-48 horas desde el inicio del EER, para facilitar un tratamiento temprano. A continuación, se detallan los hallazgos más frecuentes de laboratorio, neuroimagen y electroencefalograma (EEG) en sujetos con NORSE.
● Análisis de Laboratorio
Dada la alta frecuencia de encefalitis autoinmune como causa de NORSE, una de las partes fundamentales de los análisis de laboratorio es un estudio de autoinmunidad completo, tanto en LCR como en suero, sin olvidar la necesidad de excluir infecciones y otros procesos inflamatorios. Hasta un 70% presenta elevación de marcadores inflamatorios séricos como proteína C reactiva o velocidad de eritrosedimentación (VSG). Por otro lado, entre el 60% y 70% de los casos, tanto de NORSE criptogénico como de aquellos con causa identificada, presentan alteraciones en el análisis de LCR que, aunque son inespecíficas, sugieren un proceso inflamatorio. Los hallazgos más frecuentes son leve pleocitosis y discreta elevación de los niveles de proteínas. También se ha encontrado elevación de bandas oligoclonales o del índice de IgG en LCR en un 50% de casos. Como se indicó anteriormente se ha reportado elevación de niveles de diversas citoquinas y quimioquinas en suero y LCR de pacientes con NORSE, destacando la IL-1β, IL-6, IL-8 y CXCL10.
| Pruebas diagnósticas recomendadas para el paciente con NORSE |
| Abordaje inicial |
| • RM cerebral con y sin contraste. Angiografía por resonancia magnética (ARM), Venografía por resonancia magnética (VRM) • Monitorización continua mediante EEG. • Sangre/Suero: Hemograma completo, cultivos de bacterias y hongos, RPR-VDRL (sífilis), VIH 1-2 con carga viral confirmatoria si es apropiado. • Suero: Serología IgG e IgM para Chlamydia pneumoniae, Bartonella henselae, Mycoplasma pneumoniae, Coxiella burnetti, Shigella sp. y Chlamydia psittaci. • Hisopado nasal o nasofaríngeo (de preferencia el último): Panel de anticuerpos fluorescentes directos para virus respiratorios, SARS-CoV-2. • LCR: – Contaje celular, proteínas, glucosa, cultivos de bacterias y hongos. – PCR para VIH, VHS1, VHS2, VVZ, VEB, Mycobacterium tuberculosis. Considerar virus del Nilo Occidental, VDRL y panel de encefalitis. – Panel de epilepsia autoinmune y anticuerpos onconeuronales. – Considerar: estudio metagenómico para material genético no humano, perfil de citoquinas, citología y citometría de flujo. Recomendado en pacientes inmunocomprometidos: • Suero: IgG para Cryptococcus sp. y Toxoplasma gondii, IgG e IgM para Histoplasma capsulatum. • Esputo: Prueba molecular (PCR) para Mycobacterium tuberculosis. • LCR: eosinófilos, tinción de plata para hongos, PCR para VJC, CMV, VEB, VHH6, Encefalitis equina del este, enterovirus, influenza A/B, VIH, virus del Nilo Occidental, parvovirus, Listeria, Rubeola. • Heces: PCR para adenovirus y enterovirus. • Frotis de sangre periférica. • Inmunoensayo enzimático para enfermedad de Lyme con determinación de IgG e IgM. • Inmunoensayo para VHC y carga viral si es apropiado. • Suero y LCR para diagnóstico de Arbovirus. Paneles en suero y LCR para rickettsias, flavivirus y bunyavirus. |
| Screening Toxicológico |
| • Benzodiacepinas, anfetaminas, cocaína, fentanilo, etanol, éxtasis, metales pesados, cannabinoides sintéticos, sales de baño. Considerar: Panel de opiáceos, LSD, heroínas, fenciclidina, cannabis. |
| Autoinmune/paraneoplásico |
| • Panel de epilepsia autoinmune y paraneoplásica en suero y LCR: Incluir anticuerpos contra: LGI-1, CASPR2, Ma1, Ma2/Ta, DPPX, GAD65, NMDA, AMPA, GABA-B, GABA-A, receptor de glicina, Tr, anfifisina, CV-2/CRMP-5, neurexina-3α, adenilato quinasa, anticuerpos anti-neuronales nucleares (Hu, Yo, Ri), citoplasma de células de Purkinje, GFAP-alfa, SOX1, canales de calcio dependiente de voltaje (tipo N y tipo P/Q), receptor de acetilcolina, AQP4, MOG, IgLON5, D2R. • Estudios serológicos adicionales (probablemente no patogénicos pero que orientan a etiología autoinmune):ANA, ANCA, anticuerpos anti-tiroideos (anti-tiroglobulina y anti-TPO), anti-endomisio, velocidad de sedimentación globular, proteína C reactiva, electroforesis de proteínas séricas, factor reumatoide, enzima convertidora de angiotensina, aglutininas frías y calientes, test para SAM/LHH (triglicéridos, receptor soluble de IL-2 en suero, ferritina). |
| Screening Neoplásico |
| • TC toraco-abdomino-pélvica, ultrasonido pélvico o escrotal, mamografía, citología de LCR, citometría de flujo, marcadores tumorales, RM pélvica. • PET-TC si los anteriores no son concluyentes. • Opcional: Biopsia de médula ósea. |
| Screening Metabólico |
| • Sangre/suero: BUN/Creatinina, LDH, pruebas de función hepática, electrolitos, calcio/fósforo/magnesio, amonio. • Orina: test para porfirias. Uroanálisis y microscopia urinaria. • Considerar: Vitamina B1, vitamina B12, homocisteína, folato, lactato, piruvato, CK, troponinas, test para desórdenes mitocondriales (lactato, piruvato, espectroscopia por RM, biopsia muscular. Protoporfirinas en sangre y orina. |
| Screening Toxicológico |
| • Benzodiacepinas, anfetaminas, cocaína, fentanilo, etanol, éxtasis, metales pesados, cannabinoides sintéticos, sales de baño. • Considerar: Panel de opiáceos, LSD, heroínas, fenciclidina, cannabis. |
| Screening Toxicológico |
| • Consulta de Genética, si es posible. • Test genéticos para desórdenes mitocondriales (MERRF, MELAS, POLG1, SURF1, MT-ATP6) y adrenoleucodistrofia. • Ceruloplasmina y cobre en orina de 24 horas. • Secuenciación de exoma completo (incluir polimorfismos genéticos para IL-1β, IL-6, IL-10, TNF- α, HBMG-1, TLR-4, IL-1RN, SCN1A y SCN2A), secuenciación de genoma mitocondrial y array de hibridación genómica comparada. |
| Ensayo de citoquinas |
| Suero y LCR: Ensayo para medición cuantitativa de IL-1β, IL-1RA, IL-2, IL-4, IL-5, IL-6, IL-10, IL-12, IL-17, factor estimulante de colonias de granulocitos y macrófagos, TNFα, HMGB1, CCL2, CXCL8, CXCL9, CXCL10, CXCL11 |
● Electroencefalograma
No se han establecido marcadores diagnósticos o pronósticos en EEG para el NORSE, aunque su uso es de gran importancia para la monitorización de la evolución del paciente. Se han descrito distintos patrones de CE y descargas periódicas o epileptiformes en registros de EEG realizados en las primeras 24 horas desde el ingreso hospitalario.
Los hallazgos más frecuentes fueron las CE de inicio unilateral (46%) y descargas también unilaterales (38%), aunque también se han descrito CE y descargas bilaterales independientes, generalizadas y multifocales con menor frecuencia, sin que hubiese diferencias en las alteraciones en EEG entre NORSE criptogénico o con causa identificada.
● Neuroimagen
La resonancia magnética (RM) cerebral es la prueba de neuroimagen de elección ante la sospecha de NORSE, ya que permite identificar anomalías estructurales y descartar varias etiologías que podrían explicar el EER. Se han encontrado anormalidades no específicas en RM cerebral entre el 50% y 70% de adultos con NORSE, tratándose principalmente de lesiones hiperintensas en secuencias T2 y FLAIR. Estas lesiones pueden ser bilaterales, sobre todo en sujetos con NORSE criptogénico, o unilaterales, ubicándose con mayor frecuencia en áreas límbicas y neocorticales.
En la fase crónica del NORSE, puede haber resolución de las hiperintensidades mencionadas, siendo el hallazgo más frecuente en la RM cerebral la atrofia tanto cortical como de distribución difusa. La presencia de atrofia del hipocampo se ha relacionado con la duración del EE.
En cuanto al PET-FDG, se han observado alteraciones en esta prueba en la gran mayoría de pacientes con NORSE, incluso en etapas tempranas y en ausencia de afectación estructural en la RM cerebral, y se ha planteado como posible marcador de la enfermedad. Estas anormalidades incluyen tanto hiper como hipometabolismo, uni o bilateral, principalmente en la amígdala y el hipocampo, pudiendo persistir en algún grado tras la inmunoterapia. Además, la presencia de hipometabolismo en el PET-FDG inicial se ha mostrado como predictor de mal pronóstico funcional al momento del alta hospitalaria.

| TRATAMIENTO |
Hasta el momento, no existe tratamiento específico para el NORSE. El tratamiento inicial para el control de las CE y el EE siguen siendo los FAC tradicionales; sin embargo, estos tienen una baja tasa de efectividad, principalmente en la fase aguda del NORSE, por lo que la gran mayoría de pacientes requerirán el uso de fármacos anestésicos y hasta un tercio necesitarán múltiples anestésicos para el control de las CE. Por su parte, el uso de barbitúricos a dosis suficientes para inducir patrón brote-supresión en EEG ha mostrado detener las CE. El problema con estas opciones de tratamiento es que el uso de anestésicos se ha relacionado con peor pronóstico funcional y mortalidad en el NORSE, en tanto que la inducción prolongada de patrón brote-supresión se ha asociado a mayor duración de la ventilación mecánica, aumento del índice de complicaciones y peor pronóstico cognitivo en sujetos con EER.
Dada la fisiopatología propuesta para el NORSE, basada en un mecanismo neuroinflamatorio, se han utilizado diferentes inmunoterapias como parte de su tratamiento. Aunque se carece de ensayos clínicos que permitan demostrar la eficacia real de estos fármacos, algunos autores han sugerido una mejoría en el desenlace de los pacientes con su uso y, recomiendan su instauración temprana.
A continuación, se detallan las distintas opciones de inmunoterapia y otros tratamientos adicionales que se han ensayado en NORSE.
● Tratamientos de 1º línea
La 1º línea de inmunoterapia en el NORSE la constituyen los corticoesteroides intravenosos, Inmunoglobulinas intravenosas (Ig-IV) y plasmaféresis. Los resultados en cuanto a la eficacia de estos fármacos son dispares, llegando a ser desalentadores en algunos casos, aun cuando el tratamiento se ha iniciado de forma precoz. Sin embargo, algunas publicaciones han comunicado la eficacia del uso de pulsos de Metilprednisolona intravenosos e Ig-IV en pacientes con FIRES. Estas terapias también se han empleado de forma crónica como parte del tratamiento de la epilepsia propia de esta entidad, sin clara mejoría clínica. Por otro lado, se ha reportado control de las CE en una serie de 3 adultos con NORSE tratados con plasmaféresis, uno de ellos como primera inmunoterapia y los restantes con mala respuesta a corticoesteroides +/- Ig-IV.
● Tratamientos de 2º línea
La segunda línea de tratamiento la conforman, clásicamente, fármacos inmunosupresores como tacrolimus, azatioprina y ciclofosfamida, y el rituximab, que es un anticuerpo monoclonal quimérico anti-CD20. Estos fármacos han revelado resultados mixtos en cuanto a su eficacia en NORSE. Se han comunicado casos aislados de FIRES y mejoría tras inicio azatioprina y tacrolimus; en tanto que, estudios observacionales con números limitados de pacientes han mostrado respuesta clínica con el uso de rituximab y ciclofosfamida en NORSE criptogénico.
Por otro lado, las publicaciones más recientes sobre inmunoterapia en NORSE se basan, principalmente, en el uso de fármacos anti-citoquinas como tocilizumab y anakinra.
También se ha registrado mejoría de las CE y de los cambios electroencefalográficos asociados tras dos dosis de tocilizumab en una mujer adulta con NORSE y mala respuesta a inmunoterapia de 1º línea y rituximab. De igual manera, se ha comunicado la eficacia del tocilizumab en 6 de 7 adultos con NORSE refractario a inmunoterapia convencional (incluyendo rituximab en varios de los casos) tras 1 o 2 dosis de dicho fármaco y en un intervalo de 3-10 días desde su administración. Anakinra, un inhibidor recombinante del receptor de IL-1, se ha ensayado tanto en adultos como niños con NORSE.
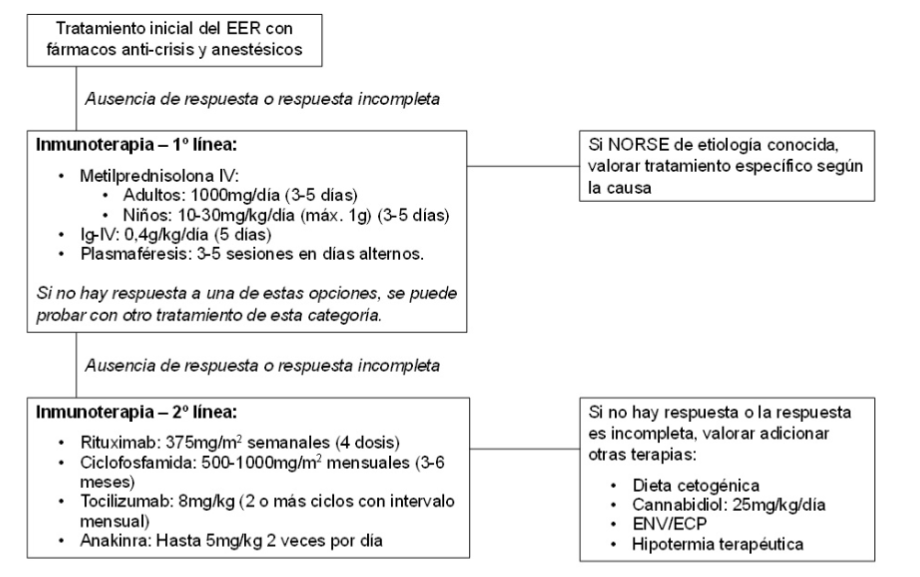
Adaptado de Sculier et al, 2018 (7); Specchio et al, 2020 (11); y Mantoan et al, 2021 (19). EER = Estado epiléptico refractario; Ig-IV = Inmunoglobulinas intravenosas; ENV = Estimulación del nervio vago; ECP = Estimulación cerebral profunda.
| PRONÓSTICO |
El NORSE suele asociarse a una alta morbimortalidad a corto y largo plazo. Durante la fase aguda del NORSE, la mortalidad oscila entre el 12% y 40% según distintas series. La mortalidad se ha relacionado principalmente con el desarrollo de complicaciones sistémicas (acidosis, hipernatremia, infecciones, etc.), el uso de anestésicos y la presencia de EE incontrolable. De aquellos supervivientes a la fase aguda, un 30% mantienen algún grado de discapacidad durante el seguimiento, con una mediana de 2 puntos en la Escala de Rankin modificada; mientras que hasta el 10% fallecen en los 6 meses siguientes.
| BIBLIOGRAFÍA |
1. Trinka E, Cock H, Hesdorffer D, Rossetti AO, Scheffer IE, Shinnar S, et al. A definition and classification of status epilepticus – Report of the ILAE Task Force on Classification of Status Epilepticus. Epilepsia. 2015;56(10):1515-23. https://doi.org/10.1111/epi.13121
2. Falco-Walter J, Bleck T. Treatment of Established Status Epilepticus. J Clin Med. 2016;5(5):49. https://doi.org/10.3390/jcm5050049
3. Gofton TE, Gaspard N, Hocker SE, Loddenkemper T, Hirsch LJ. New onset refractory status epilepticus research: What is on the horizon? Neurology. 2019;92(17):802-10. https://doi.org/10.1212/WNL.0000000000007322
4. Gaspard N, Hirsch LJ, Sculier C, Loddenkemper T, van Baalen A, Lancrenon J, et al. New-onset refractory status epilepticus (NORSE) and febrile infection-related epilepsy syndrome (FIRES): State of the art and perspectives. Epilepsia.
2018;59(4):745-52. https://doi.org/10.1111/epi.14022 5. Jayalakshmi S, Vooturi S, Sahu S, Yada PK, Mohandas S. Causes and outcomes of new onset status epilepticus and predictors of refractoriness to therapy. J Clin Neurosci. 2016;26:89-94.
6. Hirsch LJ, Gaspard N, van Baalen A, Nabbout R,Demeret S, Loddenkemper T, et al. Proposed consensus definitions for new-onset refractory status epilepticus (NORSE), febrile infection related epilepsy syndrome (FIRES), and related conditions. Epilepsia. 2018;59(4):739-44. https://doi.org/10.1111/epi.14016
7. Sculier C, Gaspard N. New onset refractory status epilepticus (NORSE). Seizure. 2019;68:728. https://doi.org/10.1016/j.seizure.2018.09.018
8. Matthews E, Alkhachroum A, Massad N, Letchinger R, Doyle K, Claassen J, et al. New-onset super-refractory status epilepticus: A case series of 26 patients. Neurology. 2020;95(16):e2280-5. https://doi.org/10.1212/WNL.0000000000010787
9. Iizuka T, Kanazawa N, Kaneko J, Tominaga N, Nonoda Y, Hara A, et al. Cryptogenic NORSE: Its distinctive clinical features and response to immunotherapy. Neurol – Neuroimmunol Neuroinflammation. 2017;4(6):e396. https://doi.org/10.1212/NXI.0000000000000396
10. Kramer U, Chi C-S, Lin K-L, Specchio N, Sahin M, Olson H, et al. Febrile infection-related epilepsy syndrome (FIRES): Pathogenesis, treatment, and outcome: A multicenter study on 77 children. Epilepsia. 2011;52(11):1956-65. https://doi.org/10.1111 / Vol. 30, No 3, 2021j.1528-1167.2011.03250.x
11. Specchio N, Pietrafusa N. New-onset refractory status epilepticus and febrile infection-related epilepsy syndrome. Dev Med Child Neurol. 2020;62(8):897-905. ttps://doi.org/10.1111/dmcn.14553
12. Sakuma H, Tanuma N, Kuki I, Takahashi Y, Shiomi M, Hayashi M. Intrathecal overproduction of proinflammatory cytokines and chemokines in febrile infection-related refractory status epilepticus. J Neurol Neurosurg Psychiatry. 2015;86(7):820-2. https://doi.org/10.1136/jnnp-2014-309388
13. van Baalen A, Vezzani A, Häusler M, Kluger G. Febrile Infection–Related Epilepsy Syndrome: Clinical Review and Hypotheses of Epileptogenesis. Neuropediatrics. 2016;48(01):005-18. https://doi. org/10.1055/s-0036-1597271
14. Jun J-S, Lee S-T, Kim R, Chu K, Lee SK. Tocilizumab treatment for new onset refractory status epilepticus: Tocilizumab for NORSE. Ann Neurol. 2018;84(6):940-5. Https://doi.org/10.1002/ana.25374
15. Kothur K, Bandodkar S, Wienholt L, Chu S, Pope A, Gill D, et al. Etiology is the key determinant of neuroinflammation in epilepsy: Elevation of cerebrospinal fluid cytokines and chemokines in febrile infection-related epilepsy syndrome and febrile status epilepticus. Epilepsia. 2019;60(8):1678-88. https://doi.org/10.1111/epi.16275
16. Clarkson BDS, LaFrance-Corey RG, Kahoud RJ, Farias-Moeller R, Payne ET, Howe CL. Functional deficiency in endogenous interleukin-1 receptor antagonist in patients with febrile infection-related epilepsy syndrome. Ann Neurol. 2019;85(4):526-37. https://doi.org/10.1002/ana.25439
17. Gugger JJ, Husari K, Probasco JC, Cervenka MC. New-onset refractory status epilepticus: A retrospective cohort study. Seizure. 2020;74:41-8. https:// doi.org/10.1016/j.seizure.2019.12.002
18. Gaspard N, Foreman BP, Alvarez V, Cabrera C, Probasco JC, Jongeling AC, et al. New-onset refractory status epilepticus. Neurology. 2015;85:1604-13. https://doi.org/10.1212/wnl.0000000000001940
19. Mantoan Ritter L, Nashef L. New-onset refractory status epilepticus (NORSE). Pract Neurol. 2021;21(2):119-27. https://doi.org/10.1136/practneurol-2020-002534
20. Farias-Moeller R, Bartolini L, Staso K, Schreiber JM, Carpenter JL. Early ictal and interictal patterns in FIRES: The sparks before the blaze. Epilepsia. 2017;58(8):1340-8. https://doi.org/10.1111/epi.13801
21. Strohm T, Steriade C, Wu G, Hantus S, Rae-Grant A, Larvie M. FDG-PET and MRI in the Evolution of New-Onset Refractory Status Epilepticus. Am J Neuroradiol. 2019;40(2):238-44. https://doi. org/10.3174/ajnr.A5929
22. Nardetto L, Zoccarato M, Santelli L, Tiberio I, Cecchin D, Giometto B. 18F-FDG PET/MRI in cryptogenic new-onset refractory status epilepticus: a potential marker of disease location, activity and prognosis? J Neurol Sci. 2017;381:100-2. https://doi.org/10.1016/j.jns.2017.08.021
23. Yanagida A, Kanazawa N, Kaneko J, Kaneko A, Iwase R, Suga H, et al. Clinically based scorepredicting cryptogenic NORSE at the early stage of status epilepticus. Neurol – Neuroimmunol Neuroinflammation. 2020;7(5):e849. https://doi.org/10.1212/NXI.0000000000000849
24. Howell KB, Katanyuwong K, Mackay MT, Bailey CA, Scheffer IE, Freeman JL, et al. Long-term follow-up of febrile infection-related epilepsy syndrome: FIRES: A Neocortical Epileptic Syndrome. Epilepsia. 2012;53(1):101-10. https://doi.org/10.1111/j.1528-1167.2011.03350.x
25. Sakuma H, Horino A, Kuki I. Neurocritical care and target immunotherapy for febrile infection-related epilepsy syndrome. Biomed J. 2020;43(3):205-10. https://doi.org/10.1016/j.bj.2020.03.009
26. Li J, Saldivar C, Maganti RK. Plasma exchange in cryptogenic new onset refractory status epilepticus. Seizure. 2013;22(1):70-3. https://doi.org/10.1016/j.seizure.2012.09.011
27. Shrivastava M. Plasma Exchange as a Therapeutic Modality in a Rare Case of Cryptogenic New Onset Refractory Status Epilepticus (NORSE). J Clin Diagn Res. 2017;11(7):ED33-4. https://doi. org/10.7860/JCDR/2017/29878.10292
28. Cantarín-Extremera V, Jiménez-Legido M, Duat-Rodríguez A, García-Fernández M, Ortiz-Cabrera NV, Ruiz-Falcó-Rojas ML, et al. Tocilizumab in pediatric refractory status epilepticus and acute epilepsy: Experience in two patients. J Neuroimmunol. 2020;340:577142. Https://doi.org/10.1016/j.jneuroim.2019.577142
29. Donnelly JP, Kasatwar N, Hafeez S, Seifi A, Gilbert A, Barthol C, et al. Resolution of cryptogenic new onset refractory status epilepticus with tocilizumab. Epilepsy Behav Rep. 2021;15:100431. https://doi.org/10.1016/j.ebr.2021.100431
30. Lai Y, Muscal E, Wells E, Shukla N, Eschbach K, Hyeong Lee K, et al. Anakinra usage in febrile infection related epilepsy syndrome: an international cohort. Ann Clin Transl Neurol. 2020;7(12):2467-74.https://doi.org/10.1002/acn3.51229
31. Westbrook C, Subramaniam T, Seagren RM, Tarula E, Co D, Furstenberg-Knauff M, et al. Febrile Infection-Related Epilepsy Syndrome (FIRES) treated successfully with Anakinra in a 21-year-old woman. WMJ. 2019;118(3):135-9.
32. Serino D, Santarone M, Caputo D, Fusco L. Febrile infection-related epilepsy syndrome (FIRES): prevalence, impact and management strategies. Neuropsychiatr Dis Treat. 2019;15:1897-903. https://doi.Vol. 30, No 3, 2021 / Revista Ecuatoriana de Neurología 77 org/10.2147/NDT.S177803
33. Thakur KT, Probasco JC, Hocker SE, Roehl K, Henry B, Kossoff EH, et al. Ketogenic diet for adults in super-refractory status epilepticus. Neurology. 2014;82(8):665-70. https://doi.org/10.1212/WNL.0000000000000151
34. Gofshteyn JS, Wilfong A, Devinsky O, Bluvstein J, Charuta J, Ciliberto MA, et al. Cannabidiol as a Potential Treatment for Febrile Infection-Related Epilepsy Syndrome (FIRES) in the Acute and Chronic Phases. J Child Neurol. 2017;32(1):35-40. https://doi.org/10.1177/0883073816669450
35. Kurukumbi M, Leiphart J, Asif A, Wang J. Vagus Nerve Stimulation (VNS) in Super Refractory New Onset Refractory Status Epilepticus (NORSE). Case Rep Neurol Med. 2019;2019:1-4. https://doi.org/10.1155/2019/7852017
36. Juhász C, Buth A, Chugani DC, Kupsky WJ, Chugani HT, Shah AK, et al. Successful surgical treatment of an inflammatory lesion associated with new-onset refractory status epilepticus.Neurosurg Focus. 2013;34(6):E5. https://doi.org/10.3171/2013.3.FOCUS1336
37. Marashly A, Lew S, Koop J. Successful surgical management of New Onset Refractory Status Epilepticus (NORSE) presenting with gelastic seizures in a 3 year old girl. Epilepsy Behav Case Rep. 2017;8:18-26. https://doi.org/10.1016/j.ebcr.2017.05.002
38. Narula N, Joseph R, Katyal N, Daouk A, Acharya S, Avula A, et al. Seizure and COVID-19: Association and review of potential mechanism. NeurolPsychiatry Brain Res. 2020;38:49-53. https://doi.org/10.1016/j.npbr.2020.10.001
39. Dono F, Carrarini C, Russo M, De Angelis MV, Anzellotti F, Onofrj M, et al. New-onset refractory status epilepticus (NORSE) in post SARS-CoV-2 autoimmune encephalitis: a case report. Neurol Sci. 2021;42(1):35-8. https://doi.org/10.1007/s10072-020-04846-z
40. Monti G, Giovannini G, Marudi A, Bedin R, Melegari A, Simone AM, et al. Anti-NMDA receptor encephalitis presenting as new onset refractory status epilepticus in COVID-19. Seizure. 2020;81:18-20. https://doi.org/10.1016/j.seizure.2020.07.006
41. Manganotti P, Furlanis G, Ajčević M, Moras C, Bonzi L, Pesavento V, et al. Intravenous immunoglobulin response in new-onset refractory status epilepticus (NORSE) COVID-19 adult patients. J Neurol. 2021;268(10):3569-73. https://doi.org/10.1007/s00415-021-10468-y
42. Karvigh SA, Vahabizad F, Mirhadi MS, Banihashemi G, Montazeri M. COVID-19-related refractory status epilepticus with the presence of SARS-CoV-2 (RNA) in the CSF: a case report. Neurol Sci. 2021;42(7):2611-4. https://doi.org/10.1007/s10072-021-05239-6
43. Aladdin Y, Shirah B. New-onset refractory status epilepticus following the ChAdOx1 nCoV-19 vaccine. J Neuroimmunol. 2021;357:577629. https://doi.org/10.1016/j.jneuroim.2021.577629

Puedes descargártelo de AQUI
